No.2ベストアンサー
- 回答日時:
安定なイオンについては既回答にある通りです。
ご質問の中から一つMgを例に挙げてもう少し細かくご説明します。
電子殻は原子核に近いところから順にK殻、L殻、M殻、N殻という名前がついているのは覚えていらっしゃると思います。
また、同時にそれぞれの電子殻に入れることのできる電子の数が決まっていて、K殻は2個、L殻は8個、M殻は18個、N殻は32個であることもわかっていらっしゃると思います。
加えて、電子配置の基本ルール2つ、(1)電子は内側の殻から順番に入る (2)最外殻電子は8つまで
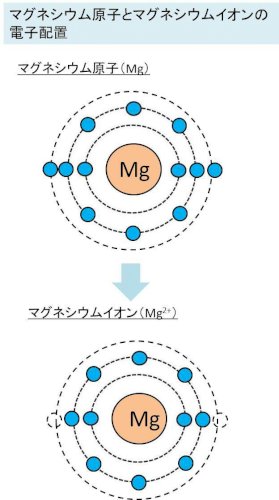
の二つを思い出しながら、添付画像をご覧ください。
上がMg原子、下がMgイオンです。
Mgの場合Kには2つ、Lには8つ電子があるので安定していますが、最も外側の殻に2つありますよね? これが余分で不安定な状態となっています。
だから、この外側の2つを放出できればL殻が最外殻となって安定できるのです。Mg原子はこの2個を放出し結果として陽子が12個、電子が10個となり、+2の電気を帯びて2価の陽イオンとなります。これがMg2+のマグネシウムイオンです。
お探しのQ&Aが見つからない時は、教えて!gooで質問しましょう!
似たような質問が見つかりました
- 化学 水素イオン濃度とpHの問題なのですが、なぜ(3)の問題だけkw=[H+][OH-]の公式を使っている 1 2023/02/20 16:46
- 化学 化学基礎 赤線を引いたところの質問です。 このLを求めるとき、なぜシュウ酸と二クロム酸カリウムのイオ 3 2023/05/14 10:05
- 化学 イオン式でのシュウ酸の表記 酸性条件での 過マンガン酸カリウムとシュウ酸ナトリウムのイオン反応式で、 1 2022/12/09 10:51
- 化学 各イオンのでき方の問題について。 ○ナトリウムイオンのでき方 ナトリウム原子は、最外殻に存在する(? 1 2023/05/05 14:15
- 化学 この問題の(ウ)についてです。金属結晶は、金属の陽イオンと自由電子で構成されていると習いました。です 4 2022/08/26 16:54
- 化学 イオン反応式について 1 2022/06/29 23:36
- 化学 理科に詳しい方、教えて下さいm(__)m 理科の問題で、「原子の集団が全体として-の電気を帯びた陰イ 4 2023/01/25 16:36
- 物理学 質量分析実験電子イオン化法 1 2022/08/02 13:35
- 化学 陰イオン交換クロマトグラフィーについて 陰イオン錯体の形成による分離の実験を行いました。 試料溶液中 1 2023/05/02 01:24
- 化学 過マンガン酸カリウムとの酸化還元反応式 (イオン式)(酸性条件)で、 シュウ酸イオンでなく、シュウ酸 1 2022/12/09 12:32
おすすめ情報
デイリーランキングこのカテゴリの人気デイリーQ&Aランキング
マンスリーランキングこのカテゴリの人気マンスリーQ&Aランキング
-
キレート滴定について。
-
今住んでる街が嫌い、ぜんぜん...
-
イオンモールを出禁になりまし...
-
単位について Eqとは?
-
この違いは???
-
ミョウバンの合成について
-
ジアンミン銀イオン溶液に硝酸...
-
イオンのレジゴーって万引きし...
-
スーパーにあるパウダードライ...
-
リプリニッシャーの 意味を教えて
-
過マンガン酸イオンと過酸化水...
-
なぜ酢酸ナトリウム?
-
塩化物イオンを塩への換算
-
あなたにとって、ドン・キホー...
-
化学で質問です。 水の電気分解...
-
再結晶でエタノールを加えた理由
-
酸化膜はなぜ電気が流れないの?
-
アンモニア性窒素とアンモニウ...
-
今酒って誰でも酒購入時に身分...
-
鉄イオンになぜFe2+とFe3+があ...
おすすめ情報


