この問題についてなのですが
「設問
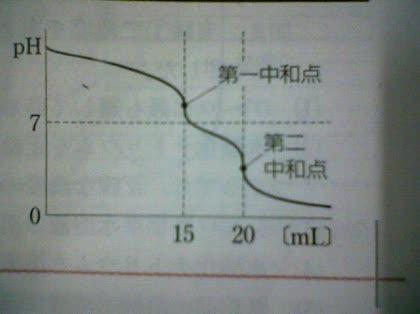
濃度未知の水酸化ナトリウムと炭酸ナトリウムの混合水溶液を20mLとり
1.0mol/Lの塩酸を滴下したところ、右図の中和的定曲線が得られた。
この混合水溶液20mLに含まれていた水酸化ナトリウムおよび
炭酸ナトリウムはそれぞれ何molか 」
「回答
水酸化ナトリウム=0.010mol
炭酸ナトリウム=0.0050mol 」
塩酸と水酸化ナトリウムが反応し、塩酸と炭酸ナトリウムも反応する(弱酸遊離)
であろうことは予想できたのですが、そこからどう解いていけばいいか思いつきませんでした。
どう考えていけばいいか教えてください。
A 回答 (3件)
- 最新から表示
- 回答順に表示
No.3
- 回答日時:
>塩酸と水酸化ナトリウムが反応し、塩酸と炭酸ナトリウムも反応する(弱酸遊離)
であろうことは予想できたのですが、そこからどう解いていけばいいか思いつきませんでした。
混ざっているというのをどうイメージしていいのかが分からないということだろうと思います。
一緒に中和されるのか、段階的に中和されるのか、それはどこから分かるのか、
ということでしょう。
(こういうことではないかと推測しています。あなたのことだから一通りは下調べはしていると思います。#1に書いてあることは多分参考書(問題集の解説)には載っていることと同じでしょう。#2は少し電離度に突っ込んで説明しています。返事が書かれていないのはそれでもしっくりきていないからでしょう。毎回のことですが、何を疑問に思ったのか、参考書の解説にあるような説明ではどこに納得できないのかが分かるような質問文を書く工夫をしてみて下さい。)
ちょっと違った説明をしてみます。
pHの変化を表しているグラフが添えられています。
このグラフから分かるということは滴定曲線のグラフも関係があるということです。
wikiで「中和滴定曲線」を引いてみます。
http://ja.wikipedia.org/wiki/%E4%B8%AD%E5%92%8C% …
酢酸を水酸化ナトリウムで滴定したグラフ(I)、炭酸を水酸化ナトリウムで滴定したときのグラフ(II)が載っています。この問題に直接関係するのは(II)ですがいきなりはちょっと混乱しそうですから(I)で考えます。
(I)0.10mol/Lの酢酸10mlを0.10mol/Lの水酸化ナトリウムxmlで滴定しています。
x=0の時は酢酸だけの水溶液のpHです。約3であることが分かります。pHが急に大きくなってからゆるくなりまた急になります。ゆるいところでは直線的に増加しています。x=10が中和点です。pH変化がきついです。中間点のx=5が一番pH変化の緩いところになっています。pHの値は約5です。これはpKaの値です。中間点ですから[CH3COOH]≒[CH3COO^-]であるとすれば平衡の式から[H^+]=Kaであることが出てくきます(この点があなたが前に質問していた「緩衝溶液」のpHです。緩衝溶液のpH変化は滴定曲線の中で考えるのが本筋です。pH変化の勾配が一番ゆるいところを使っているのが緩衝溶液です。その点で余分に酸を入れても塩基を入れてもpHが少ししか変化しないのです。あなたが書いていたような[緩衝溶液と酢酸水溶液に水酸化ナトリウム水溶液を加えて行く時とで起こっていることが異なる」というような理解は「?!」ということになります)。
グラフではNaOHをさらに10ml余分に加えています。なだらかに寝たグラフになっています。
この時水溶液の中にはどういうものがあると考えられるでしょうか。酢酸ナトリウムと水酸化ナトリウムが等量混ざった溶液になっていると考えられますね。これに塩酸(0.10mol/Lをymlとします。)を加えて行くとどのようになるでしょうか。グラフを逆に辿ったものになると考えていいのではないでしょうか。水の量がどんどん増えて行きますから濃度がいくらか薄くなります。でもグラフの特徴は変わらないとしていいでしょう。y=10でx=10の中和点に戻ります。これで余分に加えた水酸化ナトリウムが中和されています。y=20で元のx=0に戻ります。この点で酢酸ナトリウムが全部酢酸に戻ったと考えてもいいだろうということになります。x=0での急なpHの変化は中和点でのpHの変化に対応しています。さらに塩酸をい追加すればpHが一旦急に下がってからpH=1の近くにゆっくりと近づいて行くでしょう。y=30まで入れると酢酸だけの含まれていいる溶液に塩酸を10ml加えたのと内容的には同じものになっていると考えていいでしょう。塩酸と酢酸の混合溶液は第一段階の電離平衡定数が無限大、第二段階が酢酸の電離平衡定数に等しい二価の酸と同じ内容になっているとしてもかまわないだろうということになります。塩酸と酢酸の混合溶液に水酸化ナトリウム水溶液を加えて行った時の、pHは2か所で急激な変化をします。最初は余分に加えた塩酸が中和するとした時の点です。2価の酸での第一段階の中和と言っていることと同じになります。
酢酸を水酸化ナトリウムで滴定して行った時のpHの変化を表すグラフを、塩酸と酢酸の混合溶液に水酸化ナトリウム水溶液を加えて行った時のpH変化を表しているグラフとして、また酢酸ナトリウムと水酸化ナトリウムの混合溶液に塩酸を加えてい行った時のpH変化を表しているグラフとして読むことができるのです。
中和が同時に起こっているのか順番に起こっているのかの判断はもとのグラフでの判断と同じです。
塩酸と酢酸ではpHの急激な変化が2か所で起こります。2つ中和点があれば2つの関係式が出てきますから塩酸と酢酸の物質量を求めることができます。物質によってはこの急激なpHの変化が見えないような組み合わせも起こるでしょう。その場合は全体量しか分からないということになるでしょう。塩酸とシュウ酸を混ぜたとします。シュウ酸の滴定曲線を見るとpHの球な変化がはっきり見られるのは第二段階の中和のところだけです。そこでは2つの酸は全部中和されてしまっている(その場所で一度に中和されるという意味ではありません。そこまでにとにかく消費されたNaOHの量が分かるという意味です)ことになります。途中にぼやっとした段が見られるかもしれませんので精度が悪いことは承知の上で数値を手に入れるということはできるでしょう。シュウ酸のみに対応する点は塩酸を加えてしまうと全く見えなくなってしまうでしょう。
(II)炭酸に当てはめてみましょう。
炭酸に水酸化ナトリウム水溶液を加えて行った時のpH変化のグラフで水酸化ナトリウム水溶液を過剰に加えて行った場所での状態がご質問の問題の場面です。問題文の中の図とwikiの中の図を対応させてみて下さい。問題文のグラフは混合溶液の特徴を表し損ねています。問題文の図にある、塩酸の滴下量=0のところでのpHの落ち込みは水酸化ナトリウム過剰の水溶液では出てこないものです。過剰分の水酸化ナトリウム中和に対応するところはぼやっとした段があります。はっきりしているのはNa2CO3がNaHCO3に変わる段、 NaHCO3がH2CO3に変わる段です。塩酸過剰でpHのグラフを形式的に延長することはできますが架空のものです。H2CO3が分解してCO2が系外に出て行ってしまうのですから測定が意味をなさなくなります。
問題のグラフが2重におかしいところがあることになります。このことに気が付いた受験生は2つの中和点の対応を1つ前に持って行くかもしれませんね。(問題文にあるpH変化のグラフは炭酸ナトリウム水溶液に塩酸を加えて行った時のグラフを形式的に引き延ばしただけのものです。NaOHが加わることによってグラフの特徴が変わるということは全く考慮されていません。)
酢酸ナトリウムと水酸化ナトリウムの混合溶液でやれば中和点の判断も分かりやすいし、酢酸の分解も気にしなくてもいいのです。塩酸、酢酸の混合溶液ともつ合わせて考えることができますから全体的な理解には役に立ちます。なぜ、炭酸ナトリウムと水酸化ナトリウムの混合溶液という場面を問題にしたがるのでしょうか。
解答の数字を見ると水酸化ナトリウム水溶液の濃度0.50mol/L、炭酸ナトリウムの濃度0.25mol/Lです。これは普通中和滴定で使う試薬の濃度としては濃すぎます。
電離度は濃度によって変化します。それによって滴定曲線のグラフの特徴が変化してしまう場合も起こりえます。例えば硫酸です。硫酸は2価の酸ですが中和滴定のグラフでは1段階目は普通問題にしません。wikiのグラフには第一段階の電離に対応する段は見えていません。これは0.10mol/Lという濃度を選んでいるからです。0.5mol/Lという硫酸であれば段が見えてくるでしょう。
炭酸ナトリウムと水酸化ナトリウムの混合溶液でのpH変化はNaOH中和に対応するところの段はかなりぼやけていました。濃度が高くなるとこの段がハッキリしてくる可能性があります。段がハッキリしてくると順番にというイメージが強くなります。(この段は問題文の中での図では初めから無視されています。)
少し長くなりましたので混乱している部分があるかもしれません。
No.2
- 回答日時:
この問題を正確に解くには炭酸の2つの電離定数が必要です。
K1:H2CO3 ←→ H+ + HCO3-
K2:HCO3- ←→ H+ + CO32-
これらが無い場合は、NaHCO3が弱塩基性(pH=8.4)を
知っていれば出来ます。
NaOH、Na2CO3に塩酸を加えると次の3つの反応が考えられます。
A:NaOH + HCl → NaCl + H2O
B:Na2CO3 + HCl → NaCl + NaHCO3
C:NaHCO3 + HCl → NaCl + H2O + CO2
ここで、わかりやすく考えるためにNaOH、Na2CO3、NaHCO3の
pHをそれぞれ、13、12、8と考えます。
わかりやすくいうと、H+を受け取る確率が10000:1000:1ということです。
ですから塩酸を加えるとAとBの反応が進行し、Cの反応は無視してよいことがわかります。
また、第一中和点のpHは8前後であることから、Bの反応はほぼ完了したが、Cの反応は
ほとんど進行していないことがわかります。
よって、15mLの塩酸はほとんどがNaOHの中和とNa2CO3の第一段階の中和に
使われたと言えます。(0.001くらいの第二段階中和もしていますが)
第一中和から第二中和はpHが8ちょっとから4ちょっとになっています。
これはCの反応が完了したと考えると説明できます。
したがって、5mLの塩酸はNaHCO3(Na2CO3の第二段階)の中和に使われた
ということができます。
No.1
- 回答日時:
水酸化ナトリウムの始めの物質量をn_NaOH,
炭酸ナトリウムの始めの物質量をn_Na2CO3,
第1中和点に至るまで滴下されたHClの物質量をn1とする。
第1中和点に達したとき
HCl + NaOH -> NaCl +H2O
HCl + Na2CO3 -> NaCl + NaHCO3
の反応が過不足なくおこるから
(式1) n_NaOH + n_Na2CO3 = n1
第1中和点に達したときの炭酸水素ナトリウムの物質量をn_NaHCO3とすれば
(式2) n_Na2CO3 = n_NaHCO3
第1中和点より第2中和点に至るまで滴下されたHClの物質量をn2とする。
第2中和点に達したとき
HCl + NaHCO3 -> NaCl + H2O + CO2
の反応が過不足なくおこるから
(式3) n_NaHCO3 = n2
n1=15mmol, n2=5mmolだから(式1)~(式3)より
n_NaOH=10mmol, n_Na2CO3=n_NaHCO3=5mmol
お探しのQ&Aが見つからない時は、教えて!gooで質問しましょう!
おすすめ情報
マンスリーランキングこのカテゴリの人気マンスリーQ&Aランキング
-
スミチオンとジマンダイセンの...
-
硝酸の中和方法について
-
海水は何故アルカリ性ですか?
-
グリニャール反応について
-
王水の廃棄
-
強アルカリ水溶液を中和したい...
-
塩化銅水溶液はなぜ酸性になる...
-
スクロース溶液とKCl溶液の限界...
-
これは褐色ビュレット に限って...
-
尿からアンモニアを生成するこ...
-
生物の実験で二酸化マンガンと...
-
酸素系漂白剤に浸けるとアンモ...
-
エタノール沈殿での70%エタノー...
-
ボイラ缶水
-
ベンザルコニウム塩化物と塩化...
-
強アルカリは希釈すると、弱ア...
-
【エーテル臭ってどんな臭いで...
-
35〜37%の塩酸の原液から1N、1...
-
0.10mol/Lの塩酸のpHの求め方
-
酸性 アルカリ性 中性 の水溶液...
おすすめ情報
